多くの分子標的薬が近年、がんの薬物療法で使用されています。

がん領域で新しく開発される薬剤も分子標的薬の割合がとても多くなってきているように感じます。
でも、似たような名前やよくわからない複雑な作用機序をイメージしてかなり苦手意識があるので、本当に嫌いな分野ですΣ( ̄ロ ̄lll)
私みたく、思っている方は多いんじゃないでしょうか?
ということで今回、分子標的薬を理解する上で役立つイメージや、注目される薬剤の作用機序などについて勉強していこうとおもいます。

分子標的薬とほかの抗ガン薬の違い
まず、分子標的薬とほかの抗ガン薬の違いについて学びます。
がん薬物療法では、はじめに殺細胞性の抗がん薬が登場して、長い歴史のなかで多くの薬剤が開発されてきました。
殺細胞性の抗がん薬とは、細胞の核内でDNA合成や細胞増殖にかかわる分子に作用し、細胞の分裂や増殖を阻害することで効果を発揮する薬です。
しかし、活発に増殖、分裂する正常細胞に対しても毒性を示すことから、副作用などで患者さんへの身体的負担が高い薬でした。
そして、のちに分子標的薬が開発されました。
分子標的薬と殺細胞性抗がん薬との大きな違いは作用の仕方にあります。
分子標的薬は、がん細胞の増殖に関与する増殖因子や、増殖因子の受容体、細胞内シグナル伝達物質など、固有の標的分子に対して特異的に作用します。
そのため、正常細胞への影響が小さく副作用の軽減が期待される薬です。
さらに、分子標的薬のおかげで治療成績が向上したというたくさんの報告、発表などがあり、安全性だけでなく有効性の面でもがん治療に大きく貢献している薬剤です。

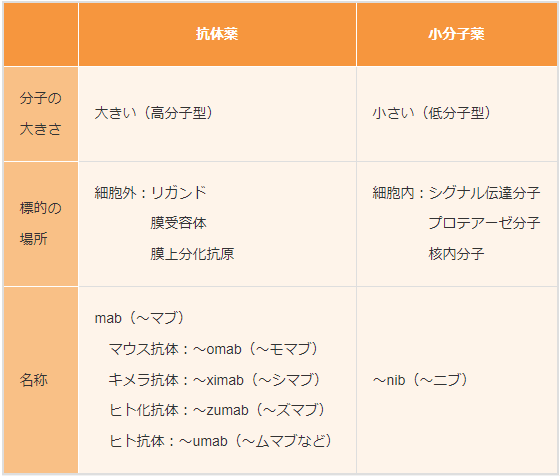
分子標的薬の分類
分子標的薬は
- 抗体薬
- 小分子薬
の2つに分類されます。
抗体薬と小分子薬は分子量の大きさや標的とする場所がことなります。
分子標的薬は似たような名称が多いですが、識別するうえで、「ニブ」か「マブ」が大きな違いとなっています。

分子標的薬の作用する場所
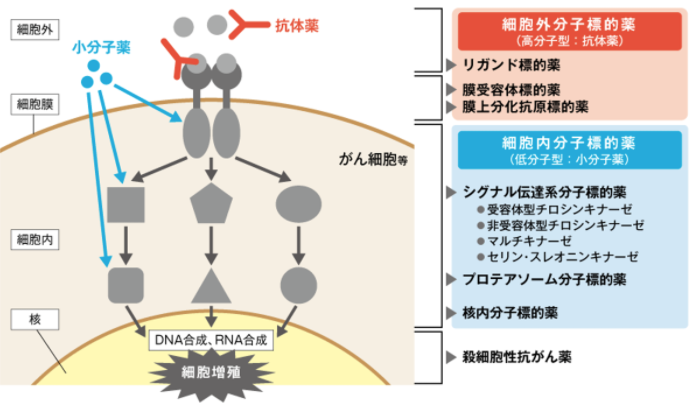

分子標的薬のターゲット
分子標的薬には、がん細胞に作用してその増殖を抑制するものだけではなく、血管内皮細胞に作用して血管新生を抑制するものもあります。
がん細胞というのは、活発に増殖するために、たくさんの栄養や酸素を得る必要があり、そのため血管を新しく作り始めます。
この血管新生の過程を分子標的薬で阻害するで、血管からがん細胞への栄養供給機能を低下させます。
血管新生阻害薬は、直接的にがん細胞を攻撃する薬ではありません。
血管新生阻害薬のイメージとして、敵を攻略するために食糧などの補給経路を絶つイメージです。
がん細胞に作用する薬剤と同様に、血管内皮細胞に作用する血管新生阻害薬にも、抗体薬(リガンドや膜受容体を阻害)と小分子薬(細胞内でのシグナル伝達経路を阻害)があります。
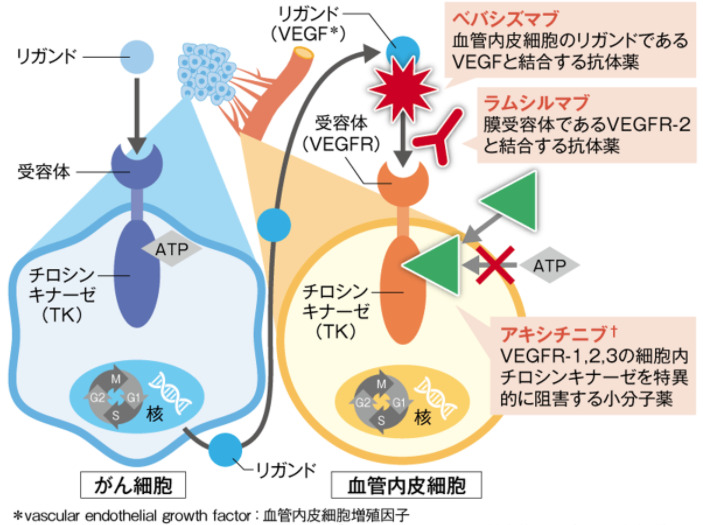
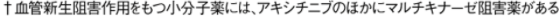

抗体薬
抗体薬は、細胞外でがん細胞の増殖にかかわるリガンドや受容体に結合して抗腫瘍効果を示します。
また、血液がんで特異的に発現する膜上分化抗原を標的として作用するものもあります。

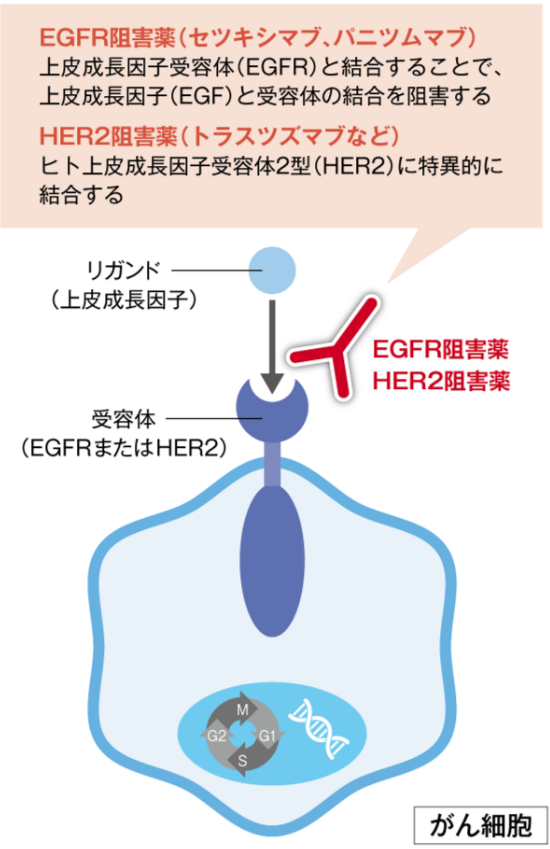
抗EGFR抗体
抗EGFR抗体は、細胞外の上皮成長因子受容体(EGFR)と結合することで、上皮成長因子(EGF)と受容体の結合を阻害します。
そしてEGFRから細胞内への増殖シグナルの伝達を抑制することにより抗腫瘍効果を示します。

抗EGFR抗体薬を使用する際には、RAS遺伝子やKRAS遺伝子の変異型だと効果が消失するため、投与前には必ず遺伝子検査を実施します。
セツキシマブはRAS遺伝子野生型の大腸癌と頭頸部癌、
パニツムマブはKRAS遺伝子野生型の大腸癌が適応となっています。
インフュージョンリアクションや発疹などが生じることがあるので投与時には要経過観察です。
抗HER2抗体

抗HER2抗体は、ヒト上皮成長因子受容体2型(HER2)に特異的に結合する抗体です。
HER2陽性の乳癌、胃癌などに適応があります。
可逆性ではあるものの心毒性があるため、アントラサイクリン系薬剤との併用は注意が必要です。
トラスツズマブはHER2受容体に結合しますが、結合した抗体薬に対して免疫細胞が集まり抗体依存性細胞介在性細胞傷害作用(ADCC)が起こることによって抗腫瘍効果を示します。
ペルツズマブはHER2受容体に結合することにより、受容体の活性化に必要なダイマー形成を阻害します。
トラスツズマブと同様に、ADCCによる効果もあります。
抗HER2抗体に殺細胞性の薬剤を結合させた抗体薬物複合体(ADC)も開発されています。
トラスツズマブにエムタンシンを結合させたトラスツズマブ エムタンシンは、トラスツズマブと同様の機序による抗腫瘍効果とともに、エムタンシンの殺細胞作用による効果もあります。
このほか、トラスツズマブにトポイソメラーゼⅠ阻害剤を結合したトラスツズマブ デルクステカンもあります。

膜上分化抗原に対する抗体薬
血液がんなどで特徴的ですが、がん細胞の表面に特異的に発現する分子(抗原)のことを「膜上分化抗原」といいます。
抗体薬の標的分子となる抗原として、「CD●●(番号)」のように表記されるいくつかの抗原や「CCR4」などがあります。
これらの標的分子に抗体薬が結合すると、補体や免疫細胞によって補体依存性細胞傷害作用(CDC)やADCCが引き起こされます。
膜上分化抗原に対する抗体薬のなかには、殺細胞性の薬剤を結合させたものや、放射性同位元素を結合させたものもあります。

小分子薬
チロシンキナーゼ阻害薬

チロシンキナーゼ阻害薬は、細胞内チロシンキナーゼ(TK)を特異的に阻害し、細胞内シグナル伝達を抑制することで抗腫瘍効果を示します。
がん細胞の受容体型チロシンキナーゼを標的としたものにEGFRチロシンキナーゼ阻害薬やEGFR/HER2阻害薬などがあります。
チロシンキナーゼはがん細胞だけでなく血管内皮細胞にもあり、それに作用するチロシンキナーゼ阻害薬もあります。
アキシチニブは血管内皮細胞のチロシンキナーゼ阻害薬です。
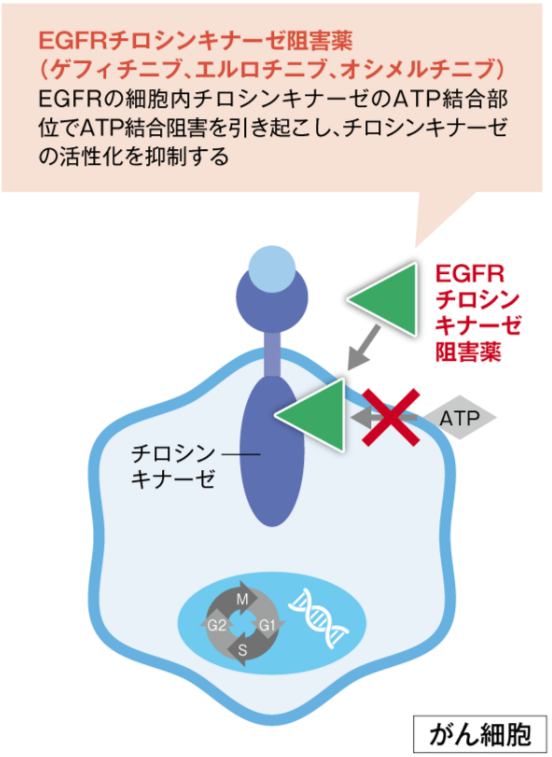
EGFRチロシンキナーゼ阻害薬

GFRチロシンキナーゼ阻害薬は、EGFRの細胞内チロシンキナーゼのATP結合部位でATP結合阻害を引き起こし、チロシンキナーゼの活性化を抑制します。
EGFR遺伝子変異陽性の非小細胞肺癌などに対するゲフィチニブやエルロチニブなどがあります。
また、オシメルチニブはEGFRの薬剤耐性変異に対してチロシンキナーゼ活性を不可逆的に阻害します。
EGFR/HER2チロシンキナーゼ阻害薬
EGFR/HER2チロシンキナーゼ阻害薬は、EGFRおよびHER2などの細胞内チロシンキナーゼを阻害します。
アファチニブはゲフィチニブやエルロチニブ同様にEGFR遺伝子変異陽性の非小細胞肺癌に対して高い有効性があります。
このほかに、HER2過剰発現が確認された乳癌に対するラパチニブもあります。
セリン・スレオニンキナーゼ阻害薬
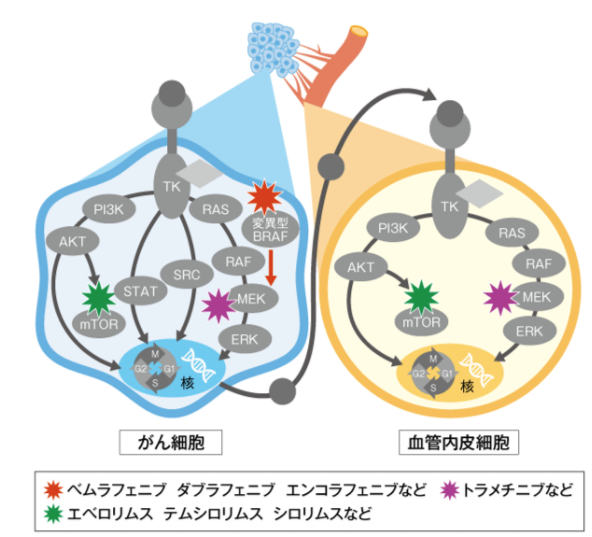
セリン・スレオニンキナーゼ阻害薬は、細胞内でのシグナル伝達に関与するmTOR、変異型BRAF、MEKなどを阻害し、がんの増殖などにかかわるシグナル伝達を阻害します。

mTOR阻害薬
mTORはPI3K/AKT経路の下流にあり、増殖因子による刺激などに反応し、タンパク質を合成して細胞増殖などを制御しています。
mTORシグナルはがん細胞の増殖だけでなく、血管新生にも関与しています。
mTOR阻害薬は、細胞内でmTORセリン・スレオニンキナーゼ活性を阻害し、PI3K/AKT-mTOR経路を抑制することで効果を示します。
VEGFやVEGF受容体を標的とした薬剤とは機序が異なる新たな血管新生阻害薬として期待されています。
mTOR阻害薬のうち、エベロリムス、テムシロリムスはmTORセリン・スレオニンキナーゼを阻害、シロリムスは活性化mTORを特異的に阻害します。
BRAF阻害薬
BRAF阻害薬はBRAF遺伝子の変異によって増殖が促進されているがん細胞において、BRAFを特異的に阻害して細胞内での増殖シグナル伝達を抑制することにより効果を示します。
ベムラフェニブ、ダブラフェニブ、エンコラフェニブなどがあり、BRAF遺伝子変異の多い悪性黒色腫などが適応となっています。
MEK阻害薬
MEK阻害薬は、細胞内のシグナル伝達経路においてBRAFの下流に存在するMEKを阻害します。
BRAF遺伝子変異のある悪性黒色腫に対し、トラメチニブはBRAF阻害薬のダブラフェニブとの併用、ビニメチニブはBRAF阻害薬のエンコラフェニブとの併用で効果が認められています。
BRAF遺伝子変異のある非小細胞肺癌に対しても、トラメチニブとBRAF阻害薬のダブラフェニブとの併用療法が施行されます。
プロテアソーム阻害薬
細胞内でタンパク質が分解処理される過程にはユビキチン‒プロテアソーム系(UPP系)が関与しており、UPP系はタンパク質の分解処理によって細胞増殖などを制御しています。
UPP系はがん治療の標的としても注目されており、プロテアソーム阻害薬によってタンパク質分解を担うプロテアソームの活性を阻害することで効果を発揮します。
多発性骨髄腫に対するボルテゾミブ、カルフィルゾミブ、経口薬のイキサゾミブなどがあります。
核内分子標的薬
CDK4/6阻害薬
がん細胞では、細胞増殖にかかわるサイクリン依存性キナーゼ4/6(CDK4/6)が過剰に発現し、細胞増殖が過剰に行われていることがあります。
ホルモン受容体陽性の乳癌でこのような傾向がみられます。
CDK4/6阻害薬はCDK4/6を選択的に阻害して機能を停止させることにより、細胞増殖を抑える作用を示します。
経口薬のパルボシクリブ、アベマシクリブが使用可能で、ホルモン受容体陽性かつHER2陰性の乳癌に対し、ホルモン剤との併用で使用します。
PARP阻害薬
DNAの修復に関係するPARP(ポリADP-リボースポリメラーゼ)という酵素を標的として作用し、DNA修復機能を抑制します。
BRCA遺伝子に変異があるときにPARP阻害薬が有効と考えられています。
オラパリブ、ニラパリブなどが開発されており、プラチナ製剤感受性やBRCA遺伝子変異陽性の卵巣癌、化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の乳癌などに適応があります。
分子標的薬をより理解するためには
自分なりにイメージを組み立てる必要があります。
現在、がんの薬物治療においては従来の抗がん薬に加え、多くの分子標的薬が使用されています。
また、経口剤の登場によって在宅での療養も可能となり、患者さんががんと共存する場面もより増えていくでしょう。
分子標的薬について理解する上では、
細胞外で作用する抗体薬か細胞内で作用する小分子薬か、
リガンド、
受容体、
細胞内シグナル伝達分子などどこを標的としているのか、
また、がん細胞、
血管内皮細胞、
免疫細胞(免疫チェックポイント)のどれに作用して効果を示すものなのか、
といった大枠を理解しておくことが非常に大切です。
免疫チェックポイント阻害薬
近年最も話題性の高いがんの薬剤だそうですwww
無関心すぎる私はよく知りませんが(笑)
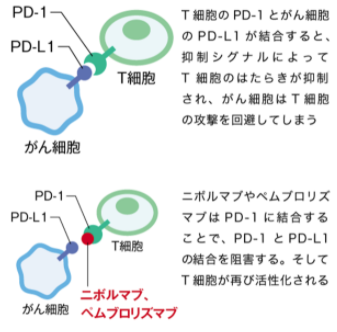
がん細胞は、細胞膜の表面上に抑制シグナル分子であるPD-L1を発現しています。
がん細胞を攻撃する活性化T細胞上にあるPD-1とがん細胞上のPD-L1が結合すると、抑制シグナルによって活性化T細胞のはたらきが抑制され、がん細胞はT細胞の攻撃を回避してしまいます。
このような、T細胞の活性化や抑制を制御する機構を「免疫チェックポイント」といいます。
がん細胞が有利になるような免疫チェックポイントにおいて阻害作用を示す薬剤として、免疫チェックポイント阻害薬が開発されました。
がん細胞が免疫細胞(T細胞)の攻撃反応に対してかけようとしているストッパーから、ガードするような薬とイメージです。
ニボルマブやペムブロリズマブは、PD-1に対する抗体薬で、T細胞上のPD-1と結合することによって、PD-1とPD-L1の結合を阻害します。
これにより、がん抗原に対して特異的に作用するT細胞が再び活性化され、抗腫瘍効果を示します。
最後に
もう、ここまで書いてもよくわからないというのが本音ですwww
本当に苦手というか、興味があまりないからなんでしょうか・・・
薬剤師としては知っておかないといけないんですけど。
どうにもこうにも頭に入らないので、とりあえずノートがてら記載しておくこととします。
また、後々ひとつずつ勉強していく中で今回の記事をおさらいしていこうかなと思います。
では(@^^)/~~~



コメント